Tiroid Hormonları
Bunlar; T3 (triiyodotironin) ve T4 (tetraiyodotironin) (tiroksin) hormonlarıdır. Sentezleri ve salınımları TSH tarafından düzenlenmektedir Kanda serum proteinlerine bağlanarak taşınırlar. Tiroksin bağlayıcı globulin (TBG); T 3’ün yarısını, T 4’ün 3/4’ünü yapısında bulundurur. Tiroksin bağlayan prealbumin (transtiretin); T 3’e karşı ilgisi olmadığı halde, T 4’ün %15- 20 kadarını taşımakta. Hormonların kalan kısmı; T 3’ün %50-60 ve T 4’ün %5-10’u albumine bağlı olarak taşınmaktadır. Serbest halde aktif olan bu hormolardan; T 3’ün %0,3’ ü ve T 4’ ün % 0,03’ü plazmada serbest olarak bulunur, bu şekilde bulunan hormonlar da; free T 3 ve free T 4 olarak adlandırılırlar.
Tiroid Hormonlarının Fonksiyonları: 1-Hücresel reaksiyonları hızlandırarak bazal metabolik hızı artırırlar, enerji tüketimini artırırlar, büyüme hızlanır, barsaklardan glukoz emilimini hızlandırırlar. 2-Hormona duyarlı lipaz aktivitesini uyararak; yağ dokusundan serbest yağ asitlerinin çıkışını artırır, yağ asitlerinin oksidasyonunu hızlandırır, serum trigliseridini azaltırlar, kolesterol emilimini azaltırlar, safra asitlerinin üretimini artırırlar, serum kolesterol düzeyini azaltırlar.
Protein sentez hızının normal olması için fizyolojik miktarlarda gereklidir. T 3’ün çok yüksek konsantrasyonları protein sentezini kısıtlar ve negatif azot dengesi ortaya çıkar. Normal büyüme ve gelişme için gereklidirler. Hipofizden GH sentezini hızlandırırlar. Erken neonatal ve geç fetal dönemlerde sinir miyelinizasyonu ve beyin büyümesi için gereklidirler. Neonatal tiroit yetmezliğinde kretenizm (cretinism) oluşur, böylece fiziksel büyüme geri kalır, beyin olgunlaşamaz, zeka seviyesi çok düşük olur.
Tiroid hormonları çekirdek düzeyinde etkilidirler. Etkileri geç başlamakta fakat uzun sürmektedir.
Temel aktif hormon olan T3, T4’e (tiroksine) oranla; 3-5 kat daha aktif, etkileri daha hızlı, proteine gevşek bağlı, dolaşım düzeyi daha düşük, yarı ömrü daha kısa (1 gün kadar), hücrelere 20 kat daha hızlı girerek kandan 20 kat daha hızlı kaybolabilme özelliğine sahiptir.
Tiroid Hormonlarının Sentezi: Sentez için gerekli iyot besinlerle alınır, ince barsaklardan emilerek kana geçer, plazma proteinlerine bağlanarak tiroide taşınır, tiroidte tiroid peroksidaz tarafından oksitlenerek aktive edilir. Aktive olan iyot tiroglobulin yapısındaki tirozil kalıntılarına bağlanarak; MİT (monoiyodotirozin) ve DİT’i (diiyodotirozin) oluşturur. Daha sonra; bir MİT + bir DİT birleşmesi ile triioyodotironin (T 3), iki DİT’in birleşmesi ile de tetraiyodotironin (T4) oluşmaktadır.
Paratiroit Hormon (PTH): 84 Aminoasitli tek zincirli, peptid yapıdadır. Tiroit bezinin arkasında bulunan 4 tane küçük bezden oluşan paratiroit bezinin esas hücrelerinden salgılanır. Biyolojik aktivitesi N ucundaki ilk 34 aminoasitlik kısmındadır. 25-34 arası aminoasitler ise hedef doku reseptörüne bağlanmayı sağlar. Molekülün COO- ucundaki 2/3 lük’kısım ise periferik dokularda yıkım ve inaktivasyonun geciktirilmesinden sorumludur. PTH; önce 115 aminoasit taşıyan öncül (prekürsör) bir molekül olarak sentezlenir. PTH, gerekli uyarılar geldiğinde salgılanmak üzere sekretuar granüllerde depolanmaktadır. PTH’ nun öncül maddesi (prekürsörü) ProPTH olarak adlandırılır. ProPTH’nun öncül maddesi ise; PreproPTH olarak adlandırılır. PreproPTH, ProPTH’dan 25 aminoasitlik bir fazlalık ile farklılık gösterir.
PTH’nun Salgılanışı: PTH’nun oluşumu ve sekresyonu düşük kalsiyum konsantrasyonlarında artar. Düşük kalsiyum konsantrasyonlarında PTH’nun yıkılımı da azalır. Serum iyonize kalsiyum düzeyinin arttığı durumlarda PTH salınımı baskılanır. Kronik magnezyum yetmezliği PTH salınımını engeller. PTH serum iyonize kalsiyum düzeyini artırır. PTH’nun hedef doku ve organlarından böbreklerde; distalden kalsiyum geri emilimini artırır, potasyum, fosfor ve bikarbonat atılımlarını artırır. Kemik dokusunda kemik dokusunun resorbsiyonuna neden olarak kalsiyum ve fosforun mobilizasyonunu sağlar, kemiğin kalsiyuma bağlama kapasitesini azaltır, çok iyi kalsifiye olmuş kemik bile aşınır. Gastrointestinal sistemde; kalsiyum ve fosforun barsaklardan emilimini artırır (intestinal kalsiyum ve fosfor emilimini hızlandıran aktif D 3 vitamininin böbreklerde 1,25-dihidroksikolekalsiferolden oluşumunu uyararak gerçekleştirir). Serum PTH seviyesi; serum kalsiyum değerlerinin 4 mg/dl ve 10.5 mg/dl arasında doğrusal olarak azalır. Serum kalsiyum düzeyinin 10.5 mg/dl veya daha da fazla olduğu durumda aktif PTH’nun varlığı hiperparatiroidinin olduğunu gösterir.
———————————————————————————————————–
Tümör Biyokimyası Ve Markerları
Tümör (kanser), vücudumuzun herhangi bir hücre veya hücre topluluğunun kontrolsüz bir şekilde çoğalması, büyümesi, çevredeki ve uzaklardaki dokulara yayılması (metastaz) sonucu dokunun, organların ve vücudun işlev görememesine yol açan ve kötü huylu (malign) ise ölüm ile sonuçlanan ciddi bir hastalıktır. Kanser ve komplikasyonlarından ölüm, birçok ülkede kardiyovasküler hastalıklardan sonra ikinci sıradadır. Kanser, uzun zamanlı süreç ve dört zorunlu faz boyunca gelişir; indüksiyon fazı, insitu faz (lokal faz), invazyon fazı, disseminasyon fazı. Kanserin, indüksiyon fazında saptanması idealdir. Ancak bilimsel olarak bu imkansızdır. Çünkü bu fazda kişide hiçbir bulgu yoktur. İkinci faz olan insitu fazda kanseri yakalamak, ikinci ideal seçenek olmaktadır.
Çeşitli vücut sıvılarındaki düzeyi tümörün varlığı ve gelişimi ile ilişkili bir maddenin tümör belirteci (marker) olduğu söylenebilir. Kanser hücrelerinin başlıca 3 karakteristik özelliği vardır; 1) Büyümenin denetiminde azalma veya ortadan kalkma, 2) Komşu dokuları işgal, 3) Vücudun diğer bölümlerine yayılma veya metastaz. Benign tümör hücreleri de büyüme kontrolünde azalma gösterir, fakat bunlar komşu dokuları işgal etmez. Büyümeyi ve diğer normal hücrelerle olan etkileşimleri denetleyen bazı genler, kanser hücrelerinde, yapı veya denetleme yönünden anormaldir. Kanser hücrelerinin incelenmesinde şu konular önemlidir; onkogenler, tümör süpresör genleri, büyüme faktörleri ve bunların reseptörleri, DNA onarım sistemleri, hücre döngüsünün düzenlenmesi.
Kansere neden olan faktörler başlıca; ışıma enerjisi, kimyasal bileşikler, virüsler, genetik yatkınlık. Genellikle, bu faktörlerin mutasyona neden olması veya yeni genlerin hücre içine girmesiyle (virüsler tarafından) kanser tetiklenir. Her üreme kuşağında, yaklaşık 0,0000001-0,000001 hücrede bir sıklıkta spontan mutasyonlar oluşur ve bunlar kansere yatkınlığı artırır. Mutasyona uğrayan kök hücrelerinde potansiyel kanser hücrelerinin oluşumundaki artış oranı, yüksek hızda üreme özelliğine sahip dokularda daha fazladır. DNA’nın oksidatif harabiyeti (örneğin, mitokondrilerden OH salınması) mutasyon hızını arttıran önemli bir faktör olabilir.
Karsinojenik ajanlar; ışıma enerjisi, kimyasal maddeler, bazı DNA ve RNA virüsleri, onkogenler. Işıma enerjisi karsinojenik olabilir. Morötesi ışınlar, x ışınları ve gama ışınları mutajenik ve karsinojeniktir. Bu ışınlar, DNA’yı çeşitli şekillerde zedeler. Işıma enerjisinin kanser yapışındaki temel mekanizma DNA hasarıdır.
Tümör Hücrelerinde Çoğunlukla Görülen Biyokimyasal Değişiklikler: Ribonükleotid redüktaz etkinliğinde artış, RNA ve DNA sentezinde artış, pirimidinlerin katabolizmasında azalma, aerobik ve anaerobik glikoliz hızında artış, izozim profillerinde, sıklıkla fetal kalıba, değişiklikler, fetal proteinlerin sentezi (örn.karsinoembriyonik antijen), farklılaşmış biyokimyasal işlevlerin kaybı (örn.özgül proteinlerin sentezinde azalma), bazı büyüme faktörleri ve hormonların uygunsuz sentezi.
| Bazı Karsinojenik Virüsler | ||
| Sınıf | Üyeler | |
| DNA virusları | ||
| Papovavirus | Poliyomavirus, SV40 virusu, insan papillomavirusları (HPV’ler) | |
| Adenovirus | Adenovirus 12, 18 ve 31 | |
| Herpesvirus | Epstein-Barr virusu | |
| Hepadnavirus | Hepatit B virusu | |
| RNA virusları | ||
| Retrovirus tip C | Fare sarkom ve lösemi virusu, kanatlı sarkom ve lösemi virusları, insan T hücre lösemi virusu I ve II | |
| Retrovirus tip B | Fare meme tümörü virusu | |
.
Onkogenler karsinojenezde kilit rol oynar. Onkogenler kanser yapabilen genlerdir. Bunların keşfi, karsinojenezi oluşturan temel mekanizmalarla ilgili araştırmalara çok büyük bir etki yapmıştır. Onkogenler, ilk önce, tümöre neden olan virusların, dönüşüm olayından sorumlu özgün genleri olarak (viral onkogenler) tanınmıştır. Onkogenler; normal hücrelerin gelişimi sırasında büyümeyi arttırır. Tümör baskılayıcı genler; normal hücrelerin gelişimi sırasında büyümesini kısıtlar. Kanser oluşumu onkogen ekspresyonunun aktivasyonu veya değişimi ile tümör baskılayıcı genlerin inaktivasyonu veya kaybı ile oluşmaktadır.
Proto-Onkogenler Çeşitli Mekanizmalarla Onkogenlere Dönüşürler: Bir genin transkripsiyonuna yani aktivasyona katılan mekanizmalar; promotör sokulması, arttırıcı sokulması, kromozom translokasyonları, gen büyütülmesi, nokta mutasyonu.
Tümör Belirteçleri: Bilim adamları ve hekimler, özgül, güvenilir ve kolaylıkla belirlenebilir bir tümör belirteci arayışını sürdürmektedirler. Ancak bu güne kadar, bu özelliklerin tümünü içeren bir bileşik bulunamamıştır. Kanserli dokulardan kaynaklanan ve çeşitli vücut sıvılarında artan pek çok biyolojik bileşik tümör belirteci olarak kullanılabilmektedir. Kanserin erken tanısı tedaviye en iyi şansı verir. Amaç kanser cerrahi yöntemlerle çıkarılabilecek kadar küçükken tanı koymaktır.
Tümör Belirtecinin Tanımı: Tümör belirteci, kanda vücut sıvılarında veya dokularda artmış miktarlarda bulunarak bir kanser tipinin varlığını düşündürebilecek bir maddedir. Kanserin varlığını belirtmek üzere nitel veya nicel olarak kimyasal, immünolojik ve moleküler biyolojik yöntemler ile ölçülürler. Morfolojik olarak kanser dokusu, normal erişkin dokusundan daha çok fetal dokuya benzemektedir.
Tümörler farklılaşmalarına göre; 1) İyi farklılaşmış, 2) Zayıf farklılaşmış, 3) Anaplastik (şekilsiz) olarak derecelendirilir. Tümör belirteçleri, tümör farklılaşım durumunun biyokimyasal veya immünolojik karşılığıdır. Genel olarak tümör belirteçleri, embriyolojik olarak bağlantılı dokuların bazı maddeleri yeniden eksprese etmesini gösterir. İdeal tümör belirteci hem belirlenen kanser türü için spesifik, hem de küçük tümörlerin erken tanısı ve taraması için yetecek kadar duyarlı olmalıdır. Tümör belirteçleri, çoğunlukla ilk tedavi tamamlandıktan sonra hastalık durumunun takibinde ve tedavi seçeneklerinin izlenmesinde kullanılır.
Tarihsel Gelişim: İlk tanımlanan tümör belirteci Bence-Jones proteinidir. 1963 yılında AFP ve 1965’de CEA’nın bulunmasına kadar tümör belirteçlerinin kanser hastalarının izlemindeki genel kullanımı başlamamıştır.
Tümör Belirteçlerinin Klinik Kullanımı: Genellikle tümör belirteçleri tanı, prognoz ve tedavinin izlenimi ile tedavi için hedef belirlenmesinde kullanılır. Tümör belirteçleri çoğu normal, benign ve kanserli dokuda bulunduğundan kanser taramaları için özgüllükleri yeterli değildir. Başarılı bir cerrahiden sonra belirteç düzeyi azalmalıdır. Eğer tedaviden sonraki yarı ömür beklenenden uzun ise tümör çıkartmada başarılı olunmamış demektir.
Enzimler: Birkaç istisna dışında enzim ve izoenzimlerdeki bir artış bir kanser tipini veya bir organ tutulumunu tanımlayacak kadar duyarlı ve özgül değildir. PAP istisnadır. Pek çok enzim organa özel olmadığı için enzimler spesifik olmayan tümör belirteci olarak kullanımı daha uygundur. Artmış enzim düzeyleri malignite varlığı konusunda uyarıcı olabilir.
| Enzim Markerı | Arttığı Tümör Tipleri |
| ACP | Prostat karsinomu |
| LDH | Ewing sarkomu, T hücreli, nonT-nonB hücreli kanser |
| PHI | Lenfoblastik lösemi, lenfoma |
| NSE | Küçük hücreli akciğer karsinomu, prostat karsinomu ve diğerleri |
| CK-BB | Prostat CA |
.
ALP: Özellikle karaciğer, kemik ve plasentada bol olmakla beraber vücuttaki tüm dokularda rastlanır. Primer ve sekonder karaciğer kanseri, kemik ve karaciğeri tutan metastatik kanserlerde, prostat CA’nın kemik metastazında (en yüksek) yüksek ALP düzeylerine rastlanır. Artmış ALP düzeylerinin kaynağını bulmak için 5’nükleotidaz veya GGT gibi diğer karaciğer enzimleri ölçülür. Trofoblastlar tarafından sentezlenen plasental ALP (PALP), normalde gebe kadınların serumlarında artar. Over, trofoblastik ve GİS kanserleri, seminoma ve Hodgkin hastalığında artar.
Kreatin Kinaz (CK): CK-1 (BB), CK-2 (MB), CK-3 (MM) olarak 3 izoformu vardır. CK-1 düzeylerinin prostat CA ve küçük hücreli akciğer kanserli bireylerde arttığı tespit edilmiştir. CK-1’in tümör belirteci olarak klinik yararlılığı ileri araştırmalar gerektirmektedir.
LDH: Malignensi olgularında LDH artışı özgül değildir. Solid tümörlerde serum LDH seviyesinin tümör kitlesi ile korele olduğu gösterilmiş olup hastalığın ilerlemesi için prognostik bir belirteç görevini görür. Tedavinin izleminde rolü kısıtlıdır.
Nöron Spesifik Enolaz (NSE): Enolaz, fosfopürivat hidrataz olarak da bilinen glikolitik enzimdir. NSE, enolazın nöronal dokular ile yaygın nöroendokrin sistem ve amin öncüllerini kullanan ve dekarboksilasyonunu yapan dokularda bulunan şeklidir. Serum NSE düzeyleri RIA yöntemi ile ölçülür. İlerlemiş nöroblastomu olan çocukların %90’dan fazlasında NSE düzeylerinin arttığı rapor edilmiştir. 4. evre nöroblastomu olan çocuklarda artmış NSE kötü prognoz ile ilişkilidir.
Prostatik Asit Fosfataz (PAP): Asit fosfatazlar, fosfat esterlerini pH 7.0’ nin altındaki optimum pH’ larda hidroliz eden bir grup enzimdir. Sekretuar epitel hücrelerinin lizozimlerinde bulunur. Primer olarak prostat bezi tarafından üretilse de PAP; eritrosit, trombosit, lökosit, kemik iliği, kemik, karaciğer, dalak gibi dokularda da bulunur. Osteogenik sarkoma, multipl myeloma, ve değişik kanserlerin kemik metaztazı gibi durumlarda serum PAP seviyesi artar. PAP klinik kullanımı yerini PSA’ya bırakmıştır.
Prostat Spesifik Antijen (PSA): PSA’nın çok yararlı bir tümör belirteci olduğu kanıtlanmıştır. İleri yaş grubu erkeklerde prostat CA en sık rastlanan kanser türüdür. Bu nedenle erken tanısı önemli olup, erken tanıda radikal prostektomi ile potansiyel tedavi yapılmaktadır. PSA, %7’si karbonhidrat olan tek zincirli bir glikoproteindir. Prostat bezinin asini ve duktuslarını döşeyen epitel hücreleri tarafından yaygın olarak üretilir. Seminal sıvıda PSA, seminal vezikül spesifik proteinini düşük molekül ağırlıklı proteinlere parçalar. PSA dolaşımda 2 şekilde bulunur: 1) Alfa-1 antikimotiripsin veya alfa-2 makroglobulin ile kompleks halde (büyük kısmı), 2) Serbest PSA (küçük bir kısmı). PSA; prostat kanserinin tanısında, evrelendirilmesinde, tedavi izleminde kullanılır. Erken tanıda, serum PSA düzeyleri rektal muayene ile birlikte kullanılmalıdır. Evrelendirmede, yüksek PSA düzeyleri ileri evreler ile eşleştirilmiştir. PSA’nın en önemli klinik yararı prostat CA’nın kesin tedavisinin izlenmesinde kullanılmasıdır. Cerrahi ile prostat dokusu alındıktan sonra, PSA’nın yarı ömrü 2-3 gün olduğu için 2-3 haftada düzeylerinin ölçüm sınırının altına inmesi gerekir. Radikal prostatektomi sonrası, PSA düzeylerinin artması hastalığın rekürrensinin kuvvetli bir göstergesidir.
Hormonlar: Kanserde hormon üretimi iki ayrı yol izler; normalde hormonu üreten dokuda üretim artışı olması ve endokrin olmayan bir dokuda hormon üretimi olması (ektopik sendrom). Örneğin; küçük hücreli akciğer kanserinde ACTH üretilmesi. Sonuç olarak bir hormonun artışı belirli bir tümör türü için tanısal olamaz.
| Hormon | Tümör Çeşidi |
| Beta-HCG | Testiküler karsinom, koryokarsinom, mol hidatiform |
| Kalsitonin | Medüller tiroid karsinom |
| İnsülin | İnsülinoma |
| Gastrin realising peptid | Gastrinoma (Zollinger-Ellison sendromu) |
| Human plasental laktojen (HPL) | Trofoblastik tümör, çeşitli karsinomlar |
| VMA ve metanefrinler | Feokromasitoma |
.
ACTH: ACTH; 39 amino aside sahip ve ön hipofiz bezinin kortikotropik hücreleri tarafından üretilen polipeptid yapıda bir hormondur. Artmış serum ACTH düzeyleri hipofiz veya ektopik kaynaklı olabilir. Çok yüksek ACTH düzeyi genellikle ektopik kaynaklıdır (küçük hücreli akciğer CA). Deksametazon supresyonunun başarısızlığı da ektopik üretim lehinedir. ACTH’ın tedavi izlemindeki rolü henüz net değildir.
Kalsitonin: Tiroidin C hücreleri tarafından üretilir. Normalde serum kalsiyum düzeylerindeki artışa yanıt olarak salınır. Kalsiyum düzeyini düşürür. Artmış düzeyi troidin medüller karsinomu ile bağlantılıdır. Kalsitonin en çok otozomal dominant geçişli bir hastalık olan ailesel medüller tiroid karsinomunun saptanmasında yararlıdır. Artmış kalsitonin düzeyinin tümör hacmi ve yakın uzak organ metastazında tümör varlığı ile ilişkili olduğu gösterilmiştir. Kalsitonin, tedavi izlemi ve hastalığın rekürrensinin saptanmasında da yararlıdır.
Koryonik Gonodotropin (CG): CG, plasental tümörler (trofoblastik tümörler) ve bazı testis tümörleri için yararlı bir tümör belirtecidir. CG normal plasentanın sinsitiotrofoblastik hücrelerinden salınan bir glikoproteindir. Artmış CG düzeylerine gebe kadınlarda, trofoblastik hastalık ve germ hücreli tümörlerde rastlanır. Artmış CG değerleri tümör hacmi ve prognozu ile ilişkilidir. Seminomalarda CG varlığı koryokarsinom varlığını belirtir. CG en fazla trofoblastik hastalığın ilerlemesinde ve tedaviyi izlemede yararlıdır. İlk CG düzeyi 400.000 IU/L veya fazla olan bir hasta tedavi başarısızlığı için yüksek risk taşır.
Onkofetal Antijenler: Onkofetal antijenler fetal yaşam sırasında üretilen proteinlerdir. Bu proteinler fetüs serumunda yüksek konsantrasyona sahipken doğumdan sonra düşük düzeylere iner veya kaybolurlar. Onkofetal antijenlerin üretimi hücrelerin malign transformasyonu sonucunda bazı genlerin yeniden aktivasyonunu gösterir.
Alfa-Fetoprotein (AFP): Hepatoselüler ve germ hücreli (non-seminoma) karsinomların belirtecidir. Embriyonik gelişim sırasında AFP fetal yolk kesesi ve karaciğer tarafından büyük miktarlarda sentezlenir. Gebe kadınlar dışında yüksek AFP değerleri kanser göstergesidir. Bu değerlerde olan hastaların yaklaşık yarısında hepatoselüler karsinom saptanır. Yüksek riskli bölgeler olan Afrika, Çin, Tayvan, Japonya ve Alaska da hepatoselüler karsinom taramaları denenmiştir. AFP, hepatoselüler CA’da tedavi izlenimi ve prognozu belirlemede kullanılır. AFP ve CG ile birlikte germ hücreli tümörlerin sınıflandırılması ve evrelendirilmesinde kullanılır.
Karsinoembriyonik Antijen (CEA): CEA, birbiri ile bağlantılı geniş bir hücre yüzeyi glikoproteinleri ailesini kapsar. CEA ailesinde 36 farklı protein tanımlanmıştır. Majör proteinler CEA ve nonspesifik cros reacting antijen (NCA) 50’dir. CEA, NCA 50 ve IG G’nin gama ağır zincirinin bölge yapısı çok benzeşmektedir. Bu nedenle CEA, immünglobilin gen ‘süper ailesinin’ bir parçasıdır. CEA’nın arttığı benign durumlar: siroz (%45), pulmaner amfizem (%30), rektal polip (%5), benign meme hastalıkları (%15), ülseratif kolit (%15). CEA’nın arttığı malign durumlar: kolorektal CA (%70), akciğer CA (%45), gastrik CA (%50), meme CA (%40), pankreatik CA (%55), over CA (25), uterus karsinomları (%40).
CEA’nın üst referans değerlerinin 5-10 katı artışı kolon kanseri varlığını kuvvetle düşündürür, fakat diğer kanserlerle bağlantılı olabileceği unutulmamalıdır. CEA kolon kanserinde evreleme ile ilişkilidir. Tedavi öncesi yüksek CEA düzeyleri metastaz varlığını düşündürür. Başarılı bir ilk tedavi sonrası CEA düzeyleri düşer. Remisyonda sabit kalır, tekrar artışı rekürrens anlamına gelir.
Karbonhidrat Belirteçler: Karbonhidrat ilişkili tümör belirteçleri, ya tümör hücresi yüzeyindeki antijenlerdir veya tümör hücresi tarafından salınırlar. Bu antijenlere karşı monoklonal antikorlar geliştirilmiştir. Enzimler ve hormonlar gibi doğal olarak salınan belirteçlerden daha özgül olma eğilimindedirler. Karbonhidrat belirteçleri yüksek molekül ağırlıklı müsinler veya kan grubu antijenleridir. Karbonhidrat belirteçleri CA olarak kısaltılır. 1-Müsin türü: CA 15-3, CA 549, CA 27.29, CA125, MCA, DU-PAN-2. 2-Kan grubu antijenleri türü: CA 19-9, CA 19-5, CA 50, CA 72-4, CA 242.
CA 15-3: CA 15-3 meme kanserlilerin %23’ünde ve metastatik meme kanserlilerin %69’unda artarken, pankreatik, akciğer, over, kolorektal ve karaciğer kanserlerinde de artar. CA 15-3 artış sıklığı oldukça düşük olduğundan primer meme CA tanısında kullanılmaz. CA 15-3 metastatik meme kanserlerin tedavi ve hastalık ilerlemesinin izleminde çok yararlıdır.
CA 549: CA 549 izoelektrik noktası pH 5.2 olan asidik bir glikoproteindir. İmmünometrik yöntemler ile ölçülür. Gebelik ve benign meme hastalıklarında hafif artışa neden olurken en çok meme kanserlerinde artar. CA 549 ilerlemiş meme kanserli hastaların izleminde, hastalık ilerlemesi ve regresyonu ile ilişkili olup metastaz saptanmasında yardımcıdır.
CA 27.29: Monoklonal bir antikor olan ve metastatik meme karsinomlu bireylerdeki asit sıvısındaki bir antijene karşı oluşan B 27.29 tarafından tespit edilmiştir. CA 27.29 katı faz yarışmalı RIA yöntemi ile ölçülür. CA 27.29 evre 2 ve evre 3 hastalığı olan bireylerde rekürren meme kanseri tanısında klinik olarak kullanılması için FDA tarafından onaylanmıştır.
CA 125: CA 125 over ve endometrium kanserleri için kullanılan bir belirteçtir. Epitelyal over tümörleri ile mülleryen kanal kökenli diğer patolojik ve normal dokular tarafından eksprese edilir. Endometrial, pankreatik, akciğer, meme, kolorektal ve diğer GİS tümörleri gibi over harici tümörlerde de CA 125 artar. Asemptomatik popülasyonda over kanseri taraması için yararlı değildir. Over kanserini diğer malignitelerden ayırmak için kullanılmaz. Yüksek CA 125 düzeyleri tümör boyu ve evrelendirilmesi ile ilişkilidir. Palpe edilebilir over kitlesi olan kadınlarda benign ve malign ayrımında yararlıdır. Bu da uygulanacak cerrahi girişimin sınırlarını belirleme açısından önemlidir. CA 125 ilk tedavi sonrası hastalık kalıntılarını saptamada yararlıdır. Rekürren metastazın saptanmasında da %75 doğrulukla kullanılır.
CA 19-9: Kolorektal ve pankreas karsinomları için bir belirteçtir. CA 19-9 normal insan pankreatik ve biliyer kanal hücreleri ile gastrik, kolonik, endometrial ve tükrük bezlerinden sentezlenir. Hem tutucu hem de sinyal antikoru olarak CA 19-9 antikorunu kullanan immünoradyometrik bir yöntem mevcuttur. CA 19-9 pankreatik kanser evreleri ile ilişkilidir. Pankreatik ve kolorektal kanserlerin takibinde de yararlıdır. Klinik ve radyografik belirtilerden 1-7 ay önce belirti verebilir.
CA 72-4: Over ve GİS karsinomları için bir belirteçtir. İmmünoradyometrik yöntem ile ölçülür.
Proteinler: Pek çok protein tümör belirteci olarak önerilmektedir. Ancak klinik yararlılıkları için ek araştırmalar gerekir.
İmmünglobulin (İG): Monoklonal immünglobulin multipl myeloma belirteci olarak 100 yıldan uzun süredir kullanılmaktadır. Monoklonal paraproteinler serum elektroforezinde globulin bölgesinde keskin bantlar oluşturur. Bence-jones proteini idrarda görülen serbest monoklonal immünglobulin hafif zinciridir. İlk tanı sırasında monoklonal İG düzeyi hastalık ilerlemesi için prognostik bir belirteçtir.
NMP 22: İdrar yollarında transizyonel hücre karsinomu olan hastaların tedavisinde idrar örneklerinde nükleer matriks proteini proteini adıverilen NMP 22 kullanılır. Nükleer matriks proteini nükleusun iç yapısını oluşturur. Kanserli hücreler tarafından salınan NMP’ler normal hücrelerden farklıdır.
Mesane Tümörü İlişkili Antijen (Bladder Tumor Associated): BTA antijenleri bazal zar proteinleri ile kompleksleşmiş yüksek molekül ağırlıklı polipeptidlerden oluşmuştur. İdrarda BTA varlığı tümör tarafından invaze edilen invaze zarı, tümörün kendisi tarafından üretimi veya her ikisini düşündürür.
Reseptörler: Östrojen ve progesteron reseptörleri meme kanseri değerlendirmesinde hormonal tedavi belirteci olarak kullanılmaktadır. Reseptörü negatif olan olgularda kemoterapi gibi tedaviler uygulanmaktadır. Reseptörü pozitif olan hastalar hormonlar ile tedavi edilmektedir. Bu hastaların sağ kalımı negatif reseptörlere göre daha uzundur.
Onkogenler: Ras genleri: sinyal iletiminde görev yaparlar. Mutasyonları; AML, nöroblastom ve lenfomalarda etkilidir. c-myc geni: transkripsiyonun düzenlenmesinde görevli. Mutasyonları; B ve T hücreli lenfoma, küçük hücreli akciğer CA’da etkilidir. C-erb B2: büyüme faktörü reseptörüdür. Meme, over, GİS kanserlerinde etkilidir. Bcl 2: apopitoz blokajı yapar. Lösemi ve lenfomada etkilidir.
Baskılayıcı Genler: Retinoblastom geni: ilk bulunan tümör baskılayıcı gendir. Ender olarak görülen bir çocukluk tümörü olan retinoblastomda etkilidir. P 53 geni: Meme CA, akciğer CA ve B hücreli lenfomada etkilidir. P 21 geni: kolorektal kanserde etkilidir.
———————————————————————————————————–
Vücut Tamponları
Organizmada metabolik olaylar sonunda çok fazla miktarda asit maddeler oluşur. Kanın hidrojen iyon konsantrasyonu ise, çok sınırlı olup hayat bu sınır içerisinde devam etmek zorundadır. Arterial kanın normal pH’sı 7,4’tür. Venöz kanda ise 7,35’e kadar iner. Çünkü fazla miktarda karbonik asit teşekkülüne sebep olan CO2 yüksek miktarda mevcuttur. pH 7,4 değerininin üstü asidoz, altı alkalozdur. İnsanın birkaç saat yaşayabileceği en düşük ve en yüksek pH değeri 6.8-7,8’dir. [H+] konsantrasyonlarındaki değişmelere karşı koyan ve vücutta asidoza ve alkaloza engel olan birçok özel sistem mevcuttur. Bu sistemler; bütün vücut sıvılarında,herhangi bir asit veya alkaliyle derhal birleşerek [H+] değişmelere karşı koyan “Tampon Sistemleri” mevcuttur. Bunlar saniyenin küçük bir bölümünde görev yapar.
Bu değişme bariz olacak olursa; 1) Solunum merkezi uyarılarak akciğer ventilasyonunun değişmesi sağlanır. Değişim 1-3 dakika içinde düzeltilir. 2) [H+] normalden saptığı zaman böbrek işe karışır, itrah edilen asit ve baz miktarı değişir, vücut sıvıları normale döner. Etkileri birkaç saat ile birkaç gün sürebilir. Tampon; zayıf bir asit ile onun eşlenik bazının tuzundan meydana gelir. pH değişikliklerine direnir.
HCO3 Tampon Sistemi: Ekstrasellüler tampon sistemidir. (CO2 + H2O) > (H2CO3) < > (H+ + HCO3−). Bu asitlerin disosiasyonu şu şekilde gibi yazılabilir: K= (H+x HCO3)/(H2CO3). İyonlaşmaya uğramamış H2CO3 yoğunluğunu ölçmek hemen hemen imkansızdır. Çünkü suda erimiş haldeki CO2 ile reversible bir denge halinde bulunur. CO2 miktarını ölçmek ise mümkündür. Bu miktar ile iyonlaşmamış H2CO3 miktarı arasında bir oran olduğundan formül aşağıdaki şekilde değiştirilebilir. K = ([H+] x [HCO3])/(CO2). İki formül arasındaki tek fark 5 nolu formülde bulunan K sabitinin 6 nolu formüldeki K sabitinden yaklaşık 1000 defa daha büyük olmasıdır. Formülü düzenlersek; pH = pK + log(HCO3-)/(CO2). Bu denklemde HCO3– ve CO2 konsantrasyonu bilinirse o çözeltinin pH’sı bilinir. Eğer eşit konsantrasyonda bulunurlarsa da pH = pK olur.
Bu denklemden anlaşıldığı gibi; HCO3 konsantrasyonu artması pH’nın alkalen yöne kayması (alkaloz), CO2 konsantrasyonunun artması pH’nın asit yöne kayması (asidoz) anlamına gelir. Böylece ventilasyon sayısını artırmak ya da azaltmakla erimiş halde bulunan CO2 miktarını etkilemek mümkündür. Diğer taraftan da böbrekler vücut sıvısında bulunan [HCO3–]’nu değiştirmek suretiyle bu sıvıların pH’nı etkileyebilir. Özet olarak bikarbonat tampon sistemini bileşenlerinden birinin veya diğerinin miktarını değiştirmek suretiyle etkili olabilirler. Karbonik asit çok zayıf bir asittir. Çünkü çok az iyonlaşır ve çözeltide iyonlaşan kısım CO2 ve H2O’ya ayrışarak konsantrasyonu azalır.
NaHCO3 ihtiva eden bikarbonat tampon çözeltisinde HCl ilave edilirse; HCl + NaHCO3 > H2CO3 + NaCl. Tuz, zayıf asite dönüşür. H2CO3 ihtiva eden bikarbonat tampon çözeltisine NaOH ilave edilirse; NaOH + H2CO3 > NaHCO3 + H2O. Kuvvetli baz, zayıf baza dönüşür. Ekstrasellüler sıvıda NaHCO3 yerine, KHCO3, CaHCO3, MgHCO3 küçük miktarlarda etkin rol oynarlar. İntrasellüler sıvıda ise NaHCO3 yerine, KHCO3, MgHCO3 olarak bulunur.
Bikarbonat tamponlama gücü; eğrinin her iki ucuna doğru az miktarda asit ve baz ilavesinin dahi pH değerinde büyük değişmelere yol açtığı fark edilmektedir.Bundan dolayı tamponlama gücü pH=pK olduğunda en yüksek düzeydedir. Diğeride bileşenlerin konsantrasyonudur. HCO3 tamponlama sistemi iki nedenden dolayı çok güçlü olduğu söylenemez. Birincisi ekstrasellüler sıvı pH’sı 7,4’tür.HCO3 pK’sı 6,1’dir yani HCO3 iyonu erimiş durumdaki CO2’den 20 kat daha fazladır. İkincisi; tampon bileşenlerinin HCO3 ve CO2 konsantrasyonları çok fazla değildir.
Hemoglobin Tampon Sistemi: Hemoglobin yalnız solunum gazlarını taşımasıyla değil aynı zamanda tamponlama kapasitesiylede önemli bir bileşiktir.pH, CO2 ve oksihemoglobin arasında kompleks bir ilişki vardır. Metabolizma sonucu oluşan CO2 çoğu eritrositlere girer ve yüksek tamponlama gücüne sahip hemoglobin tarafından tamponlanır.CO 2 kolayca eritrositlere diffüze olur ve hemoglobinin histidin aminoasidinin imidazol grupları ile kombine olarak “karbamino bileşiği” oluşturur.
R-NH2 + CO 2 > R NHCOO- + H+.
Karbamino bileşiği hemoglobinin oksijenlenme durumundan etkilenir. Hemoglobinin her 4 zincirinin her biri üzerinde 10 adet histidin artığı bulunur ve hemoglobinin tamponlama kapasitesini oluşturur. Hemoglobinin tamponlama kapasitesi, bu proteinin oksihemoglobin şeklinde, deoksihemoglobin şeklinde olduğundan daha kuvvetli bir asit oluşu nedeniyledir. Dokularda O2 gerilimi azaldığı zaman oksihemoglobin disosiye olur, hücrelere O2 verilir ve deoksihemoglobin teşekkül eder. Aynı zamanda metabolizma sonucu oluşan CO2 eritrositlere girer.
CO2 +H2O > H2CO3 > H+ + HCO3-.
Bir anyon olarak hareket eden deoksihemoglobin H+ üzerine alır asit deoksihemoglobin teşkil eder.Böylece pH’da pek az değişiklik olur. Kan akciğerlere geldiğinde bu H+ iyonları daha kuvvetli bir asit olan oksihemoglobinin teşekkülü sonucu olarak salıverilir ve yeni olarak açığa çıkan:
H+ + HCO3- > H2CO3 > CO2 +H2 O (karbonik anhidraz) ventilasyonla dışarı atılır. Kan O2 salıp, CO2 aldığı zaman pH’da düşme meydana gelebilir. Ancak açığa çıkan H+ deoksihemoglobin tarafından tamponlanır. Geriye kalan [H+] fosfat ve proteinler tarafından tamponlandığı için pH’da bir değişiklik meydana gelmez. Bu olaya izohidrik şift ya da, CO2’in izohidrik taşınışı denir.
Klorür Kayması: Yukarıdaki reaksiyonlarda anlatıldığı gibi eritrositlerdeki HCO3 konsantrasyonu yükseldiği zaman HCO3 plazmaya geçer, buna karşılıkta Cl- eritrositlere girer. Böylece elektronötralite bozulmadan kalır. Fakat osmolarite bozulduğu için hücre içine su girer ve bu nedenle korpüsküler volüm ortalaması hafifçe yükselir.
Fosfat Tampon Sistemi (İntrasellüler Tampon): Bikarbonat tampon sistemine benzer. pH= 6.8 + log ([HPO4-]/[H2PO4-]). HCl ilave edelim; kuvvetli asit + zayıf asit karışımında pH değişimi az olur. Kuvvetli baz + zayıf baz karışımında pH değişimi az olur. Fosfat tamponun pK’sı 6,8’dir. Bikarbonat tamponuna göre fizyolojik pH’ya daha yakındır. Ancak ekstrasellüler sıvıdaki fosfat tampon sistemi konsantrasyonu bikarbonat tampon sisteminin 1/6’sı kadardır. Bu nedenle ekstrasellüler sıvıda tamponlama gücü HCO3 tamponlama gücünden daha azdır. Diğer taraftan tübüler sıvıda çok fazla öneme sahiptir. Bu sıvıda çok yüksek konsantrasyonda bulunur ve bu nedenle de bu sıvıda tamponlama gücü çok yüksektir. Ayrıca tubulus sıvısı ekstrasellüler sıvıya göre daha asidik olduğu için pK değerine yakın olup tamponlama kapasitesi yüksektir.
Protein Tampon Sistemi: Proteinler aminoasitlerden meydana gelir, NH2 ve COOH gruplarına sahiptir. Serbest COO–H+ NH3 grubu bulunan aminoasitler tamponlama kapasitesine sahiptirler. İzoelektrik noktaları nedeniyle fizyolojik pH’da proteinler polianyonlar olarak hareket ederler ve ihtiyaç olduğu zaman H+ salabilirler. Asit yapıda proteinler “H” proteinler, alkali konjugatların tuzu da “B” proteinler olarak isimlendirilirler. Proteinlerin tamponlama güçleri çoğunun yapılarında taşıdıkları histidinin “imidazol” grubu iledir. Albümin 16 gruba sahiptir. Proteinlerin tamponlama kapasitelerinin %95’ten fazlasını albümin oluşturur. Globülinde tamponlama kapasitesine sahiptir. Hemoglobin toplam 36 histidin aminoasidi taşır.
Yukarıda anlattığımız tampon sistemler anlşılması kolay olsun diye tek tek anlatılmıştır. Gerçekte [H+] değişmesine sebep olan durumlarda bütün tampon sistemlerinin dengesi aynı anda değişir. Bu olaya izohidrik prensip denir. Tampon sistemlerinin herhangi birinde meydana gelen değişme diğer tampon sistemlerini etkiler. Yani tamponlar birbirini tamponlar. Yukarıda anlatılan tampon sistemi yetersiz kaldığı zaman daha etkili ve dakikalar mertebesinde, asit-baz dengesizliğinin solunumla düzenlenmesi sağlanır.
Solunumla Düzenlenme: Handerson Hasselbach denkleminden söz edilirken vücut sıvılarındaki CO2 konsantrasyonuna ait yükselmenin, pH’yı düşürerek asit tarafa doğru kaydırdığını; azaltmanın ise pH’yı yükselterek baz tarafa doğru kaydırdığından bahsedilmişti. Böylece solunum sistemi pH değerini değiştirebilme yeteneğine sahiptir. Alveoler ventilasyonun iki katına çıkması durumunda ekstrasellüler sıvı pH’yı yaklaşık 0,23 kadar arttırır (alkali tarafa kayar). Ventilasyonun 1/4 oranında azalması pH değerini 0,4 kadar düşürür (asit tarafa kayar). Medulladaki solunum merkezi alveol havasındaki CO2 veO2’nin değişen derecelerdeki kısmi basınçlarına ve kan pH’na hassastır. Solunum hızı ve derinliği arkus aorta ve karotit sinüste bulunan kemoreseptörler aracılığı ile ayarlanırlar. Yani [H+] yükseldiğinde ventilasyon artar.
Ekstrasellüler sıvıdaki CO2 yoğunluğu azalır ve bu olayla [H+] normal bir değere iner.Bunun aksine [H+] düştüğü zaman solunum merkezi depresyona uğrar, alveoler ventilasyon azalır, [H+] normal değere yaklaşır. Kısaca kanın içinde taşıdığı H2CO3 miktarı pCO2’e bağımlı oluşu nedeniyle solunum sisteminin kontrolü altındadır. pCO2 de solunum organları tarafından kontrol edilir. Sonuç olarak; kanın içinde taşıdığı H2CO3(CO2) miktarındaki değişikliklere bağlı olan bozukluklar solunumsal olarak değerlendirilir. Kanda; H2CO3 birikecek olursa CO2 eliminasyonu gerekeceğinden solunumsal asidoz, H2CO3 azalacak olursa solunumsal alkaloz oluşacaktır. Bu her iki halde de (H2CO3/HCO3) 1/20 normal oranı bozulmuş olacaktır. Bu oranın yeniden düzenlenmesi için; solunumsal asidozda böbreklerde HCO3 reabsorbsiyonunda artma ile, solunumsal alkalozda böbreklerde HCO3 salgılanmasında artma ile sağlanır. Bu olay böbrekler tarafından başarılır.Bu düzenleme ile kan içindeki H2CO3 ve HCO3 miktarı anormal ise de bu ikisinin birbirine oranı 20/1 çıkarıldığı için pH’nın normal olduğu anlamına gelir.
Asit-baz dengesinde kan içinde bulunan HCO3 değişikliklere bağlı olan bozuklukların metabolik kökenli olduğu söylenir. HCO3- miktarında bir azalma olursa (H2CO3 sabit kalmak şartıyla) metabolik asidoz oluşur. HCO3- miktarında bir artma olursa metabolik alkaloz oluşur. Kompansasyon; metabolik asidozda hiperventilasyon sonucu CO2 eliminasyonu ile, metabolik alkalozda ise solunum hareketlerinin yavaşlaması sonucu CO2 birikimi ile sağlanır (1/20 oranı). Her ikisinde de [H2CO3] ayarlanmak suretiyle kompansasyon başarılır. Plazma CO2 konsantrasyonu metabolik asidozda normalden düşük,metabolik alkalozda ise normalden yüksek olacaktır.
Böbrekler Tarafından Düzenlenme: En etkili ve uzun süreli regülasyonu sağlar. Bunu başarabilmek için tubuluslarda bir seri reaksiyonlar oluşmaktadır; proton salgılanması [H+], Na reabsorbsiyonu, HCO3 iyon çıkarılması, NH3 salgılanmasını kapsar.
H+ İyonunun Salgılanması: Proksimal, distal ve kollektör tubulusların epitelyal hücreleri ile, henle kulbunun kalın kısmı tübüler filtrata doğru H+iyonu salgılar. Kollektör tüplerde bu işlem, tübüler sıvıdaki pH’nın 4,5’a düşmesine kadar devam eder. Bu sınırda durur. [H+]’nun %84’ü proksimal tubuluslardan salgılanır. Ancak bu bölümde erişilebilecek en yüksek [H+] değeri, ekstrasellüler sıvıdaki değerin 3 veya 4 katı kadardır. Bu kolektör tüplerde ise 900 katı kadardır. Yani proksimal tubuluslardaki pH 6,9’dur (glomerüler filtrat pHsı 7,4). Distal tubuluslarda ise pH 6’ya kadar düşebilir. Tubuluslarda H+ iyonu salgılanırken aynı zamanda aktif transportla Na iyonu reabsorbsiyona uğrar. Bu şekilde tubuler sıvı ile ekstrasellüler sıvı arasındaki elektriksel denge korunmuş olur. H+ salgılanması ekstrasellüler sıvıdaki CO2 konsatrasyonu tarafından düzenlenir. Eğer [CO2] yüksek ise H+ salgılanması fazla olur. Bu nedenle extrasellüler sıvıdaki CO2 konsantrasyonunu artıran solunum azalması veya metabolik olayların hızlanması gibi hadiseler aynı zamanda H+ salgılanmasınıda artırırlar. Aksine ventilasyonda artma,metabolik olaylarda yavaşlama gibi CO2 konsantrasyonunu azaltan olaylar, H salgılanmasını azaltır H2CO3 iyonlaşmasıyla H+ +HCO3- meydana gelmektedir. Daha sonra HCO3- pretubuler sıvıya geçerek Na ile birleşir. Pratik anlamda idrara HCO3- çıkarılmaz. Sonuçta; böbrekler H+ iyonlarının HCO3- iyonlarına karşı tam olmayan titrasyon sonucu, bunlardan biri ya da diğerini idrara çıkarmakta böylece bu iyonların ekstrasellüler sıvıdan uzaklaşmasını sağlamaktadır.
Alkalozun Böbrekler Tarafından Düzenlenmesi: pH 7,4’ün üzerine çıktığı zaman HCO3- artar sonuçta böbreklerden filtre edilen H+’dan fazla HCO3- salgılanır. Çünkü CO2 azaldığı zaman H+ iyonlarının salgılanması da azalır. CO2 azalması sonucu proksimal tubulus hücrelerinden salgılanan H+ miktarı azalır yada olmaz, bunun sonucu tubuler filtrattan gelen HCO3 ile proksimal tubulus hücrelerinden salgılanan H+ birleşip H2CO3 oluşturamaz, böylelikle tübüler filtrattan gelen HCO3– idrar ile atılır, plazma HCO3 miktarı azalır, kan pH’sı asit yöne kayar.
Asidozun Böbrekler Tarafından Düzenlenmesi: pH 7,4’ün altındadır, CO2 konsantrasyonu artmıştır.Asidozda tubulusta H+ salgılanması HCO3- reabsorbsiyonundan daha fazla miktarda oluşur. Bu iyonların (H+) tamamı HCO3- ile titre edilemez. Dolayısıyle tubulus sıvılarındaki diğer tamponlar devreye girer. Ancak salgılanan H+ artımına paralel olarak reabsorbsiyonla HCO3- emilimi artar. Bu artma izohidrik prensibe göre diğer tamponları da alkaloz yöne kaydırır ve asidoz düzeltilmeye çalışılır. Bu da yetersiz kalacak olursa fosfat ve NH3 tampon sistemleri devreye girer.
Fosfat tampon sistemi; HPO4 -/H2PO4 -’ten oluşur. Bunların her ikiside tubuler sıvıda konsantre halde bulunur. Çünkü reabsorbsiyonları çok azdır.Bu nedenle fosfat tampon sistemi kanda çok zayıf olmasına rağmen tubuler sıvıda çok güçlü bir etkiye sahiptir. Böbrekler bu şekilde vücut sıvılarında mevcut olan asidozu azaltmaya çalışır. Aşırı H+ iyonları amonyak tampon sistemi aracılığı ile de idrara taşınır. NH3 tampon sistemi NH3/NH4 oluşur. Tubulus epitel hücrelerinin glutaminin deaminasyonu sonucu NH3 sentez ederler. NH3 tubuler filtrat içine verilir. Bu işlem iki şekilde önemlidir: NH4 oluştuğu için NH3 konsantrasyonu azalır.Bu olay epitelyumlar tarafından daha fazla NH3 salgılanmasını sağlar. Eğer salgılanan H+ tubuler sıvıdaki Cl- ile birleşecek olursa HCl meydana gelecekti ancak tubuler filtratın kritik değeri olan pH4,5’a çok çabuk gelinirdi ve H+ salgılanamazdı. Ama NH4 oluştuğu ve Cl ile birleştiği zaman tubuler filtratın pH’sı değişmez. Böylece asidoz düzeltilmiş olur. İdrar pHsı 4,5- 8 arası değişebilir. Normal pH 6 civarıdır.
Asidozis Türleri Ve Nedenleri: Solunuma bağlı asidozis nedenleri: Kanda CO2 birikimi buna neden olur. Ardından, solunumun felç olması, bronşiollerin daralması, alveollerin veya duktus alveolarislerin elastikiyetini kaybetmesi (amfızem) ve alveollerin sıvı ile dolması görülür. Metabolizmaya bağlı asidozis nedenleri: metabolik bozukluk sonucu kanda asit bileşiklerin artması (şeker hastalığında ketoasitlerin meydana gelmesi gibi) ve aırı ishal sonucu sindirim yolundan HCO3 kaybı.
Asidozis Düzeltme Reaksiyonları: Solunumla: A) Solunum artırılarak fazla CO2 uzaklaştırılır. B) Metabolik asitlerin ürünü olan H+, kanın depo alkalisi HCO3 tarafından tutulur ve solunumla ortadan kaldırılır. Böbreklerle: böbrekler daha çok H+ uzaklaştırırlar ve daha çok HCO3 geri emilir. Böylece kanın alkali deposu (HCO3) kana kazandırılır.
Alkalozis Türleri Ve Nedenleri: Solunuma bağlı alkalozis nedenleri: solunumun çok artması ile fazla CO2 atılması sonucu görülür. Ateşli hastalıklar, ensefalit ve salisilat zehirlenmesi hiperventilasyona neden olur, fazla CO2 atılır ve alkaloz görülür. Metabolizmaya bağlı alkalozis nedenleri: A) Fazla H+ kaybı; devamlı kusma sonucu mide asidi kaybı ve hazımsızlık – ülser için fazla antasit ilaçların alınması sonucu görülebilir. B) Vücut sıvılarına (kana) fazla alkali bileşiklerin ilavesi sonucu görülebilir.
Alkalozis Düzeltme Reaksiyonları: A) CO2 kaybı ile H+ azalınca solunum yavaşlar. B) H+ iyonu azalınca tubul sıvısına yeteri kadar H+ verilemez. Bu nedenle HCO3 geri emilimi olmaz. İdrarda kalan HCO3 beraberinde Na’u da götürür. Kanın depo alkalisi olan NaHCO3 azalır. Solunum yavaşlaması ile CO2 kaybı azaltılır. Kanda kalan CO2; (CO2 + H2O) > H2CO3 < > (HCO3 + H+) reaksiyonu ile kan pH’sı tekrar normale getirilir.
Atardamardan Kan Alma Endikasyonları: A) Asid-baz dengesinin ve kan gazlarının değerlendirilmesi gereken durumlar (solunum yetmezliği, yapay solunum aygıtındaki hastalar, kalp yetmezliği, böbrek yetmezliği, hepatik koma, genel anestezi ameliyat sonrası takip v.s.). B) Aşırı dozda ilaç alımı ve ilaca bağlı zehirlenmelerde kan ilaç düzeylerinin ve kan pH’sının saptanması (aspirin v.s.).
Arteryel Kan Almaya Hazırlık: Hastanın bilinci açıksa bilgi vererek hastayı rahatlatmak gerekir. Hasta yatar pozisyonda olmalı. Çalışılan yerde ışık yeterli olmalı. İşleme başlamadan eller sabun veya antiseptikle dikkatlice temizlenmeli. Çocuk yada bebekten alınacaksa bir yardımcı mutlaka bulunmalı. Kan alırken arteryel zedelenme dikkate alınarak uygun arter seçilmeli. Kan gazlan çalışılacaksa önce analizörün istenen parametreleri analiz yapmaya hemen hazır olup olmadığına bakılır. Laboratuara kan örneği götürmek için süre uzunsa kan örneğini-taşımak için buz kabı hazırlanmalı.
Arteryel Kan Alırken Ve Aldıktan Sonra Dikkat Edilecek Hususlar: Heparin kullanım oranı fazlaysa, örneğin dilüsyon hatası varsa, kan enjektörün total kapasitesinin altındaysa enjektördeki ölü boşluk artmış ise pCO2 değerinde hatalı sonuç çıkmasına sebep olur. Kan toplamak için anaerobik tekniğin temeli kan ile atmosfer havasını ya hiç temas ettirmemek yada asgari miktarda maruz kalmasını sağlamaktır. Arteryei kapiller kan;Kan kaybının minimum olması gerektiği durumlarda, artere girmenin riskli olduğu durumlarda veya bebeklerde kan gazı analizi için kullanılabilir. Venöz kan örneği gerekiyorsa turnike bağlandıktan sonraki birkaç saniye içinde numune alınmalı ve hastanın elini yumruk yapması engellenmelidir.
Örneklerin Taşınması Ve Analizi: Örnekler kesinlikle depo edilmezler. Örnekler özelliklerini 1 saat kaybetmezler. Taze alınan kanın pH’sı 1 satte 37 derecede 0,04-0,08 ünite, 4 derecede 0,008 ünite düşüş göstermektedir. pH’daki bu düşme glukozdaki azalmaya ve laktatdaki artmaya bağlıdır. Bu değişikliklerin primer sebebi lökositler tarafından oluşturulan glikolize bağlı olduğu düşünülmektedir. Lösemili hastalardan kan alındıktan 30 dk sonra pH ‘ daki düşme 0,6 pH ünitesinden yüksektir.
———————————————————————————————————–
Yakıt Metabolizması Regülasyonu
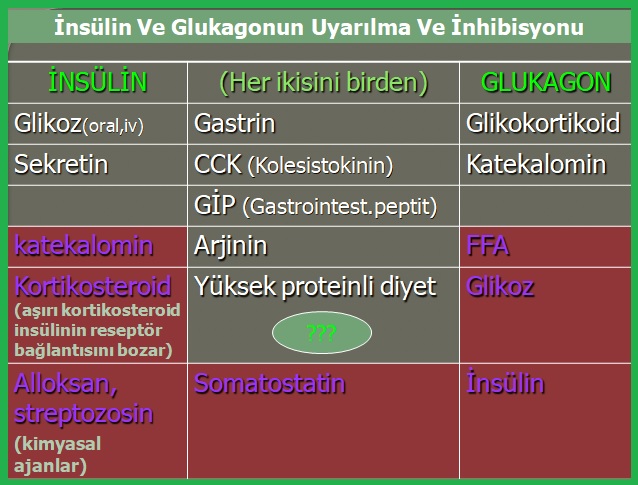
Yüksek proteinli diyet sadece insülin stimulasyonu verseydi; rejim yapanlarda düşük karbonhidrat diyeti alınması neticesinde kan şeker düzeyi insülin etkisiyle normalin altına inecek ve hipoglisemi riski oluşacaktı. Her iki hormonun birlikte olması durumunda; İnsülin, alınan diğer maddelerin anabolik yönde depolanmasını sağlarken glukagon hormonu da hipoglisemiye karşı koruyucu rol alır.
Beyin Hücreleri: Beyin hücreleri öncelikle glikozu tercih eder. Açlık dönemlerinde keton cisimlerini de kullanır. İnsülin salınım artışına bağlı hipoglisemide beyin hücreleri çok çabuk tepki verir. Açlığa bağlı hipoglisemide ise daha dirençlidir. Tokluk döneminde anabolik hormon (insülin) hakimiyetinde ketogenezis yoktur. Bu dönemde plazma keton düzeyi beynin kullanım eşiği altındadır. Yağların hidrolizinin arttığı açlık (glukagon) döneminde ketogenezis artar.
Eritrositler: Eritrositler sadece glikozu kullanır. Anaerobik metabolizma hakimdir. Oksijenin kaynağı olan eritrositlerde neden aerobik metabolizma yoktur? Sorusu düşünülmelidir.
İskelet Kası: İskelet kaslarında enerji metabolizması insülin-ve-epinefrin tarafından regüle edilir. Glukagon reseptörü yoktur.
Kalp Kası: Kalp kasında aerobik metabolizma hakimdir (sitoplazmanın yaklaşık %40’ı mitokondridir). İstirahat halinde yağ asitlerini öncelikli olarak tercih eder.
Karaciğer: Karaciğerde enerji metabolizması regülasyonu glukagon ve glikoz tarafından regüle edilir. Glikoz, glikojen sentazı stimule ederken fosforilaz enzimini de inhibe eder. Karbonhidrat, yağ asitleri, aminoasitler kullanılırken keton cisimleri karaciğerde kullanılmaz. Keton cisimleri dokularda önce asetil koA’ya çevrilmekte ve sonra enerji üretiminde kullanılmaktadır. Ketogenezis dönemlerinde karaciğerde aşırı miktarda asetil koA vardır (yağ asidi katabolizması artar). Ketogenezis zaten fazla asetil koA’lardan kurtulma yoludur. Bu nedenlerle karaciğerde keton cisimlerini kullanan enzim sistemi yoktur. (Zaten ihtiyacı da yoktur).
Adipositler: Gliserolün 3.karbonuna fosfat bağlayan enzim sistemi yoktur. Bu nedenle TG sentezi için gerekli Gliserol-3-fosfatı karbonhidrat metabolizmasından elde eder. 70 kg ağırlığındaki bireyde mevcut adipoz doku yaklaşık 15 kg.dır ve burada 140,000 kkal cıvarında enerji depolanmıştır. Hormon duyarlı lipaz katabolik dönem hormonlarının kontrolü altında yağların hidrolizini sağlar.
Hiperglisemide; glikojen sentaz aktiftir (glikogenezis), piruvat dehidrogenaz aktiftir (piruvattan asetil koA oluşumu hızlanır), asetil koA karboksilaz aktiftir (yağ sentezi). Hipoglisemide ise tam tersi metabolizma gelişir.
Epinefrin Ve Glukagon: Epinefrin alfa ve beta adrenerjik reseptörlerle, glukagon da kendi reseptörüyle etki gösterir. Alfa adrenerjik reseptörler fosfolipaz C yoluyla -IP3 ve Ca üzerinden, b adrenerjik ve glukagon ise adenilat siklaz yoluyla cAMP üzerinden etki eder (glikojen sentaz ve asetil koA karboksilaz inhibe olur, fosforilaz ve lipaz aktifleşir) (hepatik pirüvat kinaz inaktif). Sonuçta glikojen ve yağ sentezi durur, katabolizmalar artar. Bunlar; glikojenolitik, lipolitik, ketojenik ve glikoneogenetik etki gösterir. Glikoneogeneziste kortikosteroidlerin stimulasyonları unutulmamalıdır. Bu metabolizma açlık dönemlerinde gerçekleşir.
Glikoneogenezis: Karaciğerde total glikojen sadece beyinin yarım günlük ihtiyacını bile zor karşılar. Bu nedenle glikoneogenetik mekanizma ve prekürsörler önem kazanır. Radyoizotopik çalışmalar açlığın 22. saatinde dolaşım glikozunun %64’ünün, 46. saatte ise %100’ünün glikoneogenetik kökenli olduğunu göstermiştir. Laktat, piruvat, gliserol TCA ara ürünleri ve glikojenik amino asitler (lösin ve lizin hariç) prokürsördürler. Glikoneogenez, TCA ara ürünlerinin tükenmesine yol açarak TCA’yı durdurabilir. Sadece beyinin günlük glikoz ihtiyacı 120 g’dan fazladır. Bu nedenle çok yaygın bir metabolizma yoludur. Heksoz olmayan ön maddelerden glikoz sentezi anlaşılmalıdır (örneğin; galaktozdan glikoz sentezi glikoneogenez değildir). Glikoneogenez reaksiyonları bütün türlerde aynıdır ancak regülasyonlarda farklılık vardır. Başlıca karaciğerde az oranda da böbrek korteksinde olur. Bazı dokuların (örneğin kaslar) metabolik artıklarının tüketilmesinde de önem taşır. Glikoneogenezisin kontrolünde piruvat kinazın inhibisyonu son derece önemlidir. Piruvat kinazın hepatik ve kas olmak üzere iki izoenzimi vardır. Hepatik tip, fosforilasyonla ve alanin tarafından inhibe olur ve glikoneogenezis başlar. Kas tipi kesinlikle inhibe olmadığından kaslarda glikoneogenezis yoktur. Glikolizis reaksiyon basamaklarıyla 3 tanesi hariç (egzergonik, irreversibl basamaklar) ortaktır.
| Glikoneogeneziste Rol Alan Enzimler | |||
| Piruvat karboksilaz
(mitokondride) |
PEP karboksikinaz
(hem mitokondri hem stoplazma) |
Fruktoz difosfataz
(bifosfataz) |
Glikoz-6-fosfataz eksikliği |
| Kortikosteroidler stimule eder. | Glukagon ve kortikosteroidler stimule eder | Kortikosteroidler stimule eder | Kortikosteroidler stimule eder |
.
Piruvat kinazın karaciğer tipi fosforilasyon (glukagon) ve alaninle inhibe olur. Alanin artışında transaminazların stimule ettiği ALT önemlidir. İnhibe olmaz ise aynı ortamdaki PEP’ı kullanacağı için glikoneogenez durur. Piruvat karboksilaz mitokondride bulunur. Prostetik grubu biyotindir ve asitil koA tarafından allosterik olarak stimule edilir. PEP karboksikinaz enzimi hem mitokondri hem de stoplazmada bulunur.
Glikoz-6-fosfataz Eksikliği: Tip I glikojen depo hastalığı olarak bilinir. Hipoglisemi, ketozis, hiperlipidemi ve karaciğer büyümesi şekillenir. Hücre içi G-6-P düzeyi ve glikojen deposu artar.
Glikoneogeneziste sentezlenen her glikoz molekülü için 6 fosfat bağı (4ATP+2GTP) ile 2 NADH+H harcanır. Laktattan başlayan reaksiyonda PEP mitokondri içinde, diğer prokürsörlerde ise stoplazmada oluşur.